3章 〜分子標的薬〜
2章では、分子生物学的な手法を用いてがんという疾患がどのよう捉えられてきたのかを述べた。3章では、このような輝かしい研究成果を応用して作られた抗がん剤の作用メカニズムを、いくつか具体的な例を挙げながら解説していきたいと思う。この作用メカニズムには、生命のシステムとしての不思議さとそれに挑戦し続ける研究者の戦いが凝縮されていると言っても過言ではないだろう。
3.1 分子標的薬とは
これまでの抗がん剤は、前編で見てきたようにDNA合成と細胞周期に対して作用するものがほとんどであった。これらの抗がん剤はがん細胞が正常細胞よりも活発に増殖する性質を用いてがん細胞に選択的な毒性を示すものであるため、がん細胞以外の分裂速度の速い細胞、すなわち骨髄中の幼若造血細胞、口腔粘膜細胞、消化管上皮細胞、毛嚢といった細胞も同時に障害を受ける。そのため、従来の抗がん剤は骨髄抑制(白血球減少、血小板減少)、消化器障害、脱毛などの副作用を比較的共通して持っていた。
一方、分子標的薬はがん細胞で特異的に発現している、あるいは過剰発現している分子を標的とすることから、これまでの抗がん剤に比べてがん細胞に対してより選択的に作用することができると考えられている。これにより、従来の抗がん剤がその作用機序のために抱え続けてきた、上に挙げた種類の副作用の発現を抑えることが可能になる。
しかしながら、分子標的薬であるからといって副作用が存在しないわけではない。まず第一に、分子標的薬がターゲットとする分子ががん細胞以外の細胞にも発現し、かつその分子がその細胞において特定の役割を担っていた場合、その細胞の機能を抑制することによって副作用が生じる可能性がある。第二に、分子標的薬が想定された分子以外の分子と相互作用することによって未知の作用を示す可能性があり、このような場合においても副作用が生じる。この二つの可能性を常に念頭において、分子標的薬であるからと言って副作用がない、または軽いといったイメージを持つようなことがあってはならない。
3.2 分子標的薬の種類と作用機序
分子標的薬の標的分子としてはEGFR(epidermal growth factor receptor)やVEGFR(Vascular endothelial growth factor receptor)などのチロシンキナーゼ型受容体が代表的であり、それ以外にはCD20やcG250といった抗原提示分子についての研究が先行している。それらの標的分子を攻撃する分子としては主に低分子有機化合物、モノクローナル抗体、オリゴヌクレオチド、ワクチンの四種類が考えられているが、現在主流となっているのは前に挙げた二つである。
低分子有機化合物は標的分子の活性部位に安定的に結合し、標的分子の機能を阻害する。標的分子ががん細胞の増殖シグナルを伝達する役割を持っていた場合、この分子の機能を阻害することによって抗がん剤としての作用を発揮することができる。モノクローナル抗体は細胞表面に提示されたがん特異的な分子に結合し、抗原抗体反応を引き起こすことによってがん細胞を攻撃することができる。これらのモノクローナル抗体はヒト化されたものが基本になっているため、アナフィラキシー様症状などの副作用は軽減されている。
現在日本で承認されている分子標的薬は4種類あるが、このうちイマチニブ(グリーベック)とゲフィチニブ(イレッサ)は低分子有機化合物であり、トラスツズマブ(ハーセプチン)とリツキシマブ(リツキサン)はモノクローナル抗体である。以下、これらの分子標的薬の作用機序を順に述べることにする。
3.3 イマチニブ
イマチニブは慢性骨髄性白血病に特異的に発現しているチロシンキナーゼを阻害することによって増殖シグナルを止め、抗がん作用を発揮することを目的に開発された分子標的薬である。なお、イマチニブの商品名は「グリベック」である。
3.3.1 創薬ターゲット(イマチニブ)
慢性骨髄性白血病のうち9割において、フィラデルフィア染色体と呼ばれる特殊な染色体の形成が見られることが知られている。この染色体は、9番染色体と22番染色体の間で相互転座が起こり二つの染色体の一部が組み変わったもので、その結合部位では22番染色体に存在するbcr遺伝子の前半部分と9番染色体に存在するabl遺伝子の後半部分とが結合している。そのため、そこから作られるタンパク質は通常のABLタンパク質とは異なる活性を持ったABLタンパク質(p210BCR-ABL)となる。通常のABLタンパク質はあるシグナルを受け取った時にのみ活性化して基質タンパク質のチロシンをリン酸化するチロシンキナーゼ活性を示すが、p210BCR-ABLはシグナルの有無に関わらず常に活性化されたような状態になっており、そのため常に高いチロシンキナーゼ活性を示す。慢性骨髄性白血病における細胞の異常な増殖と分化は、このp210BCR-ABLが引き起こすチロシンのリン酸化が増殖・分化のシグナル伝達経路を活性化するためであると考えられた。従って、このp210BCR-ABLタンパク質のチロシンキナーゼ活性を抑えることができれば、この疾患を抑えることができると考えられる。このようにして、p210BCR-ABLタンパク質を標的分子とする治療薬の開発が始まった。
3.3.2 開発の経緯(イマチニブ)
p210BCR-ABLタンパク質のようなチロシンキナーゼには活性部位が二つあり、一つはリン酸化されるチロシン残基を持ったシグナル分子が結合する基質結合部位であり、もう一つはそのチロシン残基に結合するリン酸を供給するためのATP結合部位である。ところで、生体内では多数のチロシンキナーゼがシグナル伝達分子として働いており、その全てのチロシンキナーゼを阻害してしまった場合、重大な副作用が生じることが考えられる。ATPは全てのチロシンキナーゼが必要とする共通の分子であるが、基質結合部位はそれぞれが対象とする基質によって異なるため各チロシンキナーゼに特異的であり、選択的な阻害作用が期待された。そのため、当初はこの基質結合部位をターゲットにした創薬研究が行われたが、どれも世に出るまでにはいたらなかった。
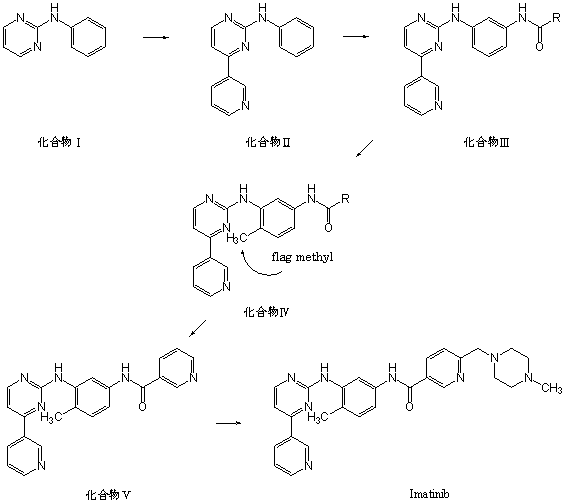
1990年代の半ばから、ATPに拮抗的に働く阻害剤がチロシンキナーゼに対する優れた選択性と強力な阻害活性を示すことが明らかになり、ATP結合部位をターゲットとした創薬研究がスタートした。まず、リード化合物Ⅰがセリン・スレオニンプロテインキナーゼであるプロテインキナーゼCに対してATP拮抗型阻害形式を持つ化合物としてスクリーニングから見出された。次に、このリード化合物Ⅰに3'-ピリジル基を導入した化合物Ⅱは、enaminones化合物経由で短工程かつ効率よい合成経路で得られ阻害活性も高まったが、p210BCR-ABLタンパク質に対してだけでなくプロテインキナーゼCに対しても強い阻害活性を示し、選択性が低いものであった。続いて化合物Ⅱにアミド基を導入するとp210BCR-ABLタンパク質に対する阻害活性をより強力にすることができたが、プロテインキナーゼCに対する阻害活性を消失させることはできなかった。(化合物Ⅲ)しかし、さらに化合物Ⅲにメチル基(flag methyl)を導入すると、チロシンキナーゼに対する阻害活性は変わらないままにプロテインキナーゼCに対する阻害活性を消失させることができた。(化合物Ⅳ)最後に、化合物ⅣのRがフェニルアミノ基である化合物ⅤにN-メチルピペラジンを導入し溶解性と経口のバイオアベイラビリティを向上させてイマチニブが完成した。

3.3.3 薬効のメカニズム(イマチニブ)
イマチニブの誘導体(化合物Ⅴ)とABLタンパク質の複合体のX線結晶解析から、化合物ⅤはABLタンパク質のATP結合部位であるactivation loopに複数の水素結合及びファンデルワールス相互作用により非常に強固に結合していることが分かっている。その中でも特に、ABLタンパク質の315番目のスレオニン(Thr315)と化合物Ⅴの二級アミンの水素結合が極めて重要な役割を担っていることが分かった。すなわち、Thr315に相当するアミノ酸は他のプロテインキナーゼではメチオニンに置換されたものが多く、ABLを特徴付けているアミノ酸だからである。さらに、イマチニブが効かない患者9人のうち6人のabl遺伝子配列を調べると、315番目のアミノ酸がThr(ACT)からIle(ATT)へと変わるポイントミューテーションが入っていた。このため、イマチニブとABLの相互作用が弱くなり、十分な阻害活性を示すことができなかったものと考えられる。
3.4 トラスツズマブ
トラスツズマブは転移性乳がんの予後悪化に関係している上皮成長因子受容体(EGF受容体)、HER2(Human Epidermal growth factor Receptor type 2)に結合するヒト化マウスモノクローナル抗体である。この抗体の結合によってHER2からの増殖シグナルを阻害し、抗がん作用を発揮することを目的に開発された分子標的薬である。なお、トラスツズマブの商品名は「ハーセプチン」である。
3.4.1 創薬ターゲット(トラスツズマブ)
HER2タンパク質は分子量185,000の糖タンパクで、細胞膜を貫通するように細胞表面に存在して細胞増殖の制御に深く関わっていると考えられている。このタンパク質は、増殖因子に対する受容体構造を持っている。すなわち、細胞の外側には増殖因子と結合するバインディングサイトを持ち、細胞の内側にはチロシンキナーゼ活性を持つ部位が存在する。このチロシンキナーゼ部位は増殖因子の結合によって活性化され、細胞内の特定のタンパク質のチロシン残基を活性化することによって細胞の分裂・増殖を刺激するシグナル伝達経路を活性化する。1980年代後半から1990年代前半までの研究により、乳がん患者の25~30%ではHER2が過剰に発現しており、このHER2過剰発現の患者はがんの進行が早く、また転移しやすく化学療法やホルモン療法が効きにくいということが知られていた。HER2タンパク質をコードする遺伝子は正常では17番染色体に1コピーずつ、合計2コピーが存在している。しかし、HER2過剰発現の乳がんではHER2をコードするDNAが、2コピーよりも多く存在することが明らかになった。そこで、検査によってHER2タンパク質の過剰発現もしくはHER2遺伝子の増幅が分かった乳がんに対しては、HER2タンパク質のチロシンキナーゼ活性を低下させることによって乳がんの増殖を抑えられることが期待された。このようにして、HER2タンパク質を標的分子とする治療薬の開発が始まった。
3.4.2 開発の経緯(トラスツズマブ)
免疫系で働く抗体は、特定の物質を認識して特異的に結合し、それによってその物質が生体内に進入し、機能することを阻害する。そこで、HER2を認識するような抗体を作り、このタンパク質の働きを阻害するとともに抗原抗体反応によりがん細胞を排除しようという方法が考えられた。しかしこの方法には、HER2は正常細胞でも発現しているため、「非自己」の認識による抗HER2抗体は産生されないという問題があった。
そこで、体外でHER2に対する大量の抗体を作り、体内に戻すことで免疫反応を引き起こすことが考えられた。まず、マウスに対して免疫にHER2を過剰発現しているヒト由来のA431細胞を用い、モノクローナル抗体を作成した。しかし、マウス由来の抗体をそのままヒトに適用するわけには行かない。一つは、マウス由来の抗体をヒトが異物として認識するためすぐに分解され、半減期が短いこと。さらには、ヒトとマウスではFc鎖のアミノ酸配列が異なるため、マウス由来の抗体はヒトの補体系を活性化できず、また抗体依存性の細胞性細胞障害を起こすことができない。このような理由により、マウス由来のモノクローナル抗体はたとえHER2に結合するものであっても薬としての利用は不可能であった。
これらの欠点を改善するために、抗原認識部位のみをマウス由来の抗体から受け継ぎ、それ以外の部分をヒト由来の抗体で構成したヒト化抗体が作成された。これがトラスツズマブである。この薬はHER2を認識する部位のみがマウスで作成したモノクローナル抗体由来であり、それ以外の配列を全てヒト由来の抗体のもので置き換えている。そのため、ヒトの抗体由来の配列の割合を95%にまであげることが可能となり、上で挙げた補体系や細胞性細胞障害に対する作用を持ったものとなっている。
3.4.3 薬効のメカニズム(トラスツズマブ)
トラスツズマブが細胞表面のHER2に結合すると、そのヒト化部分を認識したナチュラルキラー細胞及びマクロファージによる抗体依存性細胞障害作用により、抗腫瘍作用を発揮する。また、HER2の細胞内移行や分解の促進によってその数自体を減少させ、継続的に生じる増殖シグナルを低減させることによって増殖を抑制する。なお、この薬はモノクローナル抗体であるのでHER2のみに作用することが考えられるが、HER2は正常組織の細胞表面にも発現しており、その正常組織にも何らかの作用を与える可能性は残されている。
3.5 リツキシマブ
ヒトCD20抗原に対するヒト化マウスモノクローナル抗体で、CD20陽性のB細胞性ホジキンリンパ腫に用いられる。CD20はB細胞にのみ発現しており、リツキシマブはCD20を認識し、免疫を活性化してB細胞を枯渇させる。なお、リツキシマブの商品名は「リツキサン」である。
3.5.1 創薬ターゲット(リツキシマブ)
CD20抗原は297個のアミノ酸からなる約35kDaのリンタンパク質であり、細胞表面に4回膜貫通型の膜タンパク質として存在している。細胞膜では4量体のチャネル構造を形成してカルシウムチャネルとして機能し、B細胞の活性化によりCD20の発現が高進してリン酸化されると細胞内カルシウム濃度が上昇する。このような機構により細胞回転やB細胞分化に必要な細胞活性を制御していると考えられている。CD20抗原はB細胞以外のヒト細胞には発現していない。さらに、その中でも幹細胞やproB細胞には発現しておらず、preB細胞から発現し、未熟B、成熟B、活性化B細胞に発現している。B細胞性悪性リンパ腫の95%にこの抗原が発現しており、最も一般的な細胞表面抗体となっている。
3.5.2 開発の経緯(リツキシマブ)
キメラ型抗CD20抗体リツキシマブは、ヒトIgG1定常部とIgG1型マウス型抗CD20抗体重鎖および軽鎖の可変部がキメラ化された抗体であり、遺伝子発現ベクターをCHO(Chinese hamster ovary)細胞に導入することによって量産される。がん細胞に特異的に発現しているタンパク質に結合する抗体を作って投与し、免疫系を活性化することによってがん細胞を攻撃するというコンセプトはトラスツズマブと共通である。キメラ化する理由もトラスツズマブの項に書いたとおりであり、これによって異種抗体産生低下、血中半減期延長に加えて、ヒト補体系の活性化や抗体依存性細胞介在性細胞障害作用の活性化効率が約1000倍に増強される。
3.5.3 薬効のメカニズム(リツキシマブ)
リツキシマブがCD20抗原に作用するとそのまま細胞表面にとどまり、マクロファージやナチュラルキラー細胞による抗体依存性細胞介在性細胞障害作用や、補体依存性細胞障害作用により強い免疫反応を示してがん細胞を攻撃する。さらに、抗体単独によるCaspase-3の活性化とアポトーシス(細胞死)誘導が判明している。なお、CD20はこの特異抗体が反応しても血中に遊離しない性質を利用して放射性免疫療法においても標的として利用されている。
3.6 ゲフィチニブ
非小細胞肺がんでは主要細胞内の上皮成長因子受容体(EGFR)の発現量と病期の進行、転移、予後などが相関していることが分かっており、EGFRの特異的チロシンキナーゼ阻害剤が開発されてきた。ゲフィチニブはATPと競合的にEGFRの自己リン酸化を抑制し、がんの増殖、浸潤、転移と言ったがんの悪性化に関連するシグナルをブロックすることにより抗腫瘍効果を発揮すると考えられている。なお、ゲフィチニブの商品名は「イレッサ」である。
3.6.1 創薬ターゲット(ゲフィチニブ)
EGFRはEGFなどの増殖因子が結合する細胞外ドメインと、チロシンキナーゼ部位を有する細胞内ドメインをもつ細胞膜貫通型の受容体である。非活性化状態ではリン酸化を受けにくい1量体として存在しているが、EGFなどの増殖因子が結合すると2量体を形成し、細胞内のチロシンキナーゼATP結合部位にATPが結合することで、自己リン酸化し、活性化された状態になる。EGFRの自己リン酸化によって、PI3K(phosphatidylinositol 3-kinase)やAkt、Ras、MAPK(mitogen-activated protein kinase)などのタンパク質が連鎖的にリン酸化され、がん増殖シグナルが核へと伝えられ、その結果、がん細胞の増殖、血管新生、浸潤及び転移、アポトーシスの抑制などが起こる。そのため、このEGFRのチロシンキナーゼ活性を抑えることができれば、がんの進展を抑える事ができるのではないかと考えられた。
3.6.2 薬効のメカニズム(ゲフィチニブ)
ゲフィチニブは、細胞内のEGFRチロシンキナーゼATP結合部位に特異的に結合する。そこでATPと競合することによりEGFRの自己リン酸化を阻害し、がん増殖のシグナル伝達を遮断する。その結果、がんの増殖抑制、血管新生阻害、浸潤および転移の抑制、アポトーシスの誘導が生じ、腫瘍縮小効果を発揮すると考えられている。また、ゲフィチニブは殺細胞的な作用だけでなく、静細胞的な面も持つと従来言われているが、これにはMAP kinaseやCDK(cyclin-dependent kinase)を介して細胞をG1期にとどめる作用が関与するという報告もある。しかしながら、この薬に関しては創薬ターゲットの明確さに比べて薬効に関しては疑問が残されている状態である。この問題に関しては次章で詳しく述べることにする。
3.7 参考文献
奥村 勝彦 et.al.,特集 分子標的薬の基礎知識を理解する,「薬局」,vol.56, No.4 (2005) .
掛谷 秀昭・長田 裕之,がん征圧と化学‐最新抗がん剤事情,「化学と工業」,第55巻第5号(2002).
秋山 徹,「シグナル伝達がわかる」,羊土社,2001年.