第3章 〜テロメア短縮〜
ヒトの正常体細胞を培養しても無限には分裂できず、50~70回分裂すればもはや分裂できなくなる。この原因はテロメアの短縮にある。テロメアは染色体の末端にある保護構造であり、細胞分裂によりDNA複製が行われる度に短縮していく。そしてテロメアが一定の長さ以下になると細胞は分裂を停止してしまう。このためテロメアは「分裂時計」あるいは「細胞分裂数の回数券」ともいわれている。この章ではテロメア短縮と個体の老化の関係について見ていく。
3.1テロメア
3.1.1テロメアの構造
ゲノムDNAは二本鎖からなる二重らせん構造をしており、らせんの骨格部分はリン酸と糖から成っている。そして2本のらせん部分の内側では、アデニン(A)、グアニン(G)、シトシン(C)、チミン(T)と呼ばれる塩基が向かい合い、アデニンはチミンと、シトシンはグアニンと結合し、塩基対を作っている。
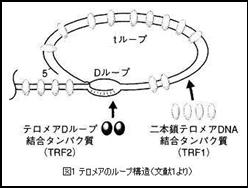
このゲノムの末端にあるのがテロメアDNAである。ヒトの場合、テロメアDNAは各染色体の末端に 5’-(TTAGGG)n-3’ という6塩基の繰り返し配列でおよそ1万塩基対存在しており、また3’ 末端では100塩基ほど突出(オーバーハング)して一本鎖になっている。図1のようにテロメアには二本鎖テロメアDNA結合タンパク質(TRF1)が結合していて、tループと呼ばれる大きなループ構造を形成している。そして一本鎖オーバーハング部分が二本鎖DNA部分を少し開いてもぐりこみ、テロメアDループ結合タンパク質(TRF2)が結合して二本鎖を形成している。この部分はDループと呼ばれている。こうして形成されたループ構造は、テロメアDNAの一本鎖や末端の存在を隠し、DNA末端がDNA損傷と認識されないようにしている。また、ループの形成には一定の長さのテロメアDNAが必要であり、テロメアが短縮しループを形成できなくなるとDNAの末端は異常なDNA末端として認識される。
3.1.2テロメアの短縮と細胞分裂の停止
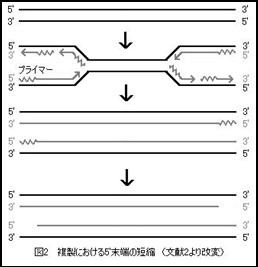
細胞が分裂する過程でDNAの複製が行われるが、直鎖状染色体DNAが複製されるとき、新生DNA鎖の5’端は鋳型に比べて短くなる。これは末端複製問題とよばれており、DNA複製がプライマーとよばれる核酸の断片から一方向にDNAを合成していく反応であるために鋳型鎖の3’最末端(新生鎖の5’末端)が合成されないことが原因で起こる(図2)。また、鋳型鎖の5’端も複製後に分解されるため、新生鎖と鋳型鎖はともに複製の度に5’末端が50~150塩基ずつ短縮していく。つまり5’末端から遺伝子が失われていくことになるが、テロメアが付いているためテロメアが短縮していくことになる。そして、テロメアDNAが5千塩基対程度になると分裂寿命の限界に達し、細胞周期はDNAの準備段階であるG1期で止まり、分裂は起こらなくなる。テロメアはヒト細胞1個あたり92存在するが、その中の一箇所でも一定の長さより短くなれば、細胞分裂は停止する。特に、染色体末端のテロメアのうち第17染色体短腕のテロメアが短く、テロメア短縮を検知している。なお、細菌やミトコンドリアなどがもつ環状のDNAでは末端複製問題が起こらないため、DNAが複製で短くなることはない。したがってテロメアは存在せず分裂寿命も存在しない。
テロメアが短縮すると細胞分裂が停止するのは、テロメア短縮を感知してp53とよばれる癌抑制遺伝子産物が作られるためである。このp53は転写因子となってp21とよばれるタンパク質を形成し、P21が細胞周期の促進機構であるサイクリン依存性キナーゼ(CDK)を阻害するために細胞は分裂を止める。また、P53は老化の過程でDNAの損傷の著しい場合には細胞そのものをアポトーシスさせる。分裂を止めた老化細胞そのものは長期生存でき、細胞死はこのようなアポトーシスまたはネクローシスの過程をとる。
語注
アポトーシス:個体をより良い状態に保つために起こる管理された細胞の自殺。予定細胞死。
ネクローシス:血行不良や外傷等で細胞内外の環境の悪化により細胞死が起こること。壊死。
3.1.3 外因によるテロメア短縮
テロメア短縮の進行には周りの環境も影響する。例えば、過剰栄養が高コレステロールなどを起こし寿命を縮めることは知られているが、テロメアに関しても細胞分裂が短時間に起こるためにその短縮が早まることが確認されている。
第4章で取り上げる活性酸素も、ヒト老化を進行させる外因である。高酸素下で細胞を培養すると、テロメアDNAは5千塩基対程度にまで急速に短縮し細胞は増殖停止する。さらにテロメアDNAのもつグアニンは酸化による変異を受けやすく、変異するとTRF2の結合が低下し、テロメアのループ構造を作れなくなり細胞は増殖を停止する。またこうした変異はp53による細胞死も促進する。
3.2 テロメラーゼ
3.2.1 テロメラーゼによるテロメア延
ヒトの通常の体細胞は分裂回数に限りがある有限分裂寿命細胞である。しかし生殖細胞は分裂を繰り返してもテロメアDNAが短縮しない。すなわち無限分裂寿命細胞である。これはテロメアDNAを延長するテロメラーゼという酵素が発現しているためである。生殖細胞にテロメラーゼが発現しているおかげで、子孫には一定の長いテロメアを伝えることが出来る。このテロメラーゼは受精卵から発生初期の組織でも発現しているが、ある時期から体細胞のテロメラーゼの発現は抑えられ、有限分裂寿命になる。成人ではテロメラーゼの発現はほとんどの体細胞で見られないが、骨髄や上皮細胞など再生系組織の幹細胞には弱い活性があり、テロメア短縮を遅延させている。
3.2.2 癌とテロメラーゼ
癌は活性酸素などによる変異が原因である。その変異は正常細胞の増殖に必要な癌遺伝子に起こり、異常増殖を促進する。また一方で癌抑制遺伝子が変異によって不活性化を起こすと、細胞にアポトーシスが誘導されなくなる。その結果、体細胞が急速に増殖する。これが癌である。こうしてできた小さな癌はテロメアが短縮するまでは成長するが、やがてテロメアが極端に短くなり、テロメアを失った染色体が互いに結合したり、異常な切断を起こしたりする。大部分の初期癌細胞は、このような染色体の異常や複製による遺伝子末端の消失で死滅する。しかし、ここで偶然にテロメラーゼが発現し、無限分裂寿命を獲得した癌細胞だけは成長し臨床的な癌にまで発達する。このように癌とテロメラーゼの発現には深い関係がある。そのため、医療の現場では癌の診断にテロメラーゼ活性の測定が行われることもある。
こうした癌の変異は60兆個あるヒトの体細胞で頻繁に起こりうるが、テロメラーゼが体細胞で抑制されているために癌にはなりにくいとされている。一方、マウスの細胞はテロメラーゼがわずかに発現しており、ヒトの細胞よりも癌化が容易である。つまりテロメラーゼの発現は細胞の癌化の可能性を高める恐れがある。
3.3テロメアと個体の老化
3.3.1細胞の分裂寿命と個体の老化
老人でも多くの細胞は分裂可能であり、100歳のヒトでも全身の細胞が増殖を停止しているわけではない。しかし、例えば抹消リンパ球の平均テロメア長は、早いと60歳を過ぎる頃から5千塩基対にまで短縮するため、一部のリンパ球が増殖不全に陥り、免疫機能の低下や異常が起こる可能性がある。また、損傷と修復を繰り返す部位の血管内皮細胞では、分裂が進みテロメアが健常な部分よりも短縮し、修復不全により動脈硬化などを起こすことも考えられる。一般に正常な状態にある組織では、一生の間に、ある組織内全ての細胞が増殖限界に達することは無い。しかし、特に障害と再生を繰り返した部位などでは分裂寿命の限界がきて、組織の機能不全が起こり、組織ごとに特有の老化症状が現れる。このように、細胞の分裂寿命は個体の老化の一因であるといえる。
しかし、老化は体細胞が分裂寿命の限界に達するよりも、明らかに早い時期から現れる。この原因のひとつとして考えられているのが、通常は微妙にコントロールされている生理活性因子の発現が変化することによって起こる組織の機能変化である。分裂時計が進むにつれて種々のサイトカインや生理活性ペプチドの産生・分泌が変化することがわかってきており、この変化が広範囲の調節系等に影響を与え、個体の老化に繋がると思われる。また、神経細胞などの非分裂細胞の場合テロメア短縮は起こらないが、脳の老化においてはグリア細胞などの分裂細胞が分裂時計の進行とともにサイトカイン分泌を含めた細胞機能が低下し、神経細胞の機能に大きく影響を与えている。
3.3.2 ヒトと他の動物の違い
ヒトの体細胞はテロメラーゼ活性をもたず、誕生の時点で1万から1万5千塩基対あるテロメア長は、異なる組織であってもおよそ年間100塩基対ほど短くなっていき、細胞増殖の限界である5千塩基対に近づく。これに対して無脊椎動物の体細胞はテロメラーゼ活性を持つものが多く、脊椎動物でも魚類を始め、哺乳類のマウスやハムスター等の体細胞でもテロメラーゼ活性がある。また、類人猿を含む霊長類でもテロメア長は4万から5万塩基対もあり、一生のうちに増殖限界までテロメアが短縮することはない。つまりヒトはテロメア短縮が個体の老化に関わる可能性のある例外的な動物といえる。
3.4 テロメアに関する研究
3.4.1 テロメア延長による若返り
テロメアの短縮によって細胞機能は変化してしまうが、テロメラーゼ遺伝子を導入することで、細胞のテロメアを延長させ、増殖機能や増殖因子の発現等の細胞機能を若返らせることができる。全身の細胞のテロメアを延長することは難しいが、老化した組織を修復するために、細胞の一部を取り出してテロメアを延長させ、若返らせてから自己移植するといった応用の可能性はある。ただし、3.2.3で述べたようにテロメラーゼの発現は細胞を癌化させる可能性を高めるため、導入したテロメラーゼ遺伝子を除去あるいは不活性化してから使用することは必要であろう。また、テロメラーゼを導入しても無限増殖にはいたらず、やがて老化する細胞もあり、まだ課題は多い。
3.4.2 今後の研究展開
テロメア長を回復して成熟体細胞に無限寿命を与えることは可能であり、有性生殖によらずに成熟体細胞から個体を新生させたクローンヒツジは既に誕生している。
しかし、テロメアとテロメラーゼの機能にはまだよく分からないことも多い。ヒト培養体細胞の多くはテロメア短縮が進んでいなくても培養環境が不適切なために増殖を停止することがあるが、このような細胞にテロメラーゼを導入するとしばしば分裂回数が増える。これはテロメラーゼがテロメア延長とは別の機能により細胞の増殖を助けている可能性を示唆している。また、テロメラーゼの導入は癌化表現型に対する抵抗性を示すという報告もある。もちろん、テロメラーゼが細胞の癌化と関係があるのは先に述べたとおりであるし、逆にテロメラーゼ阻害剤による癌の治療薬も開発されている。これらについては更なる検証および研究が必要であろう。
テロメア短縮で全ての老化現象を説明できるわけではない。しかしテロメア短縮に伴う細胞機能の老化は、器官の老化や全身的な調節システムの老化に影響を与えていると言ってよいだろう。また、医療の発達や老化研究の進展等により、ヒトの寿命がより長くなった場合、通常では増殖限界までテロメアが短縮しない組織においても、テロメア短縮による機能不全が起こることも考えられる。それを防ぐためにもテロメア長の延長は必要であり、テロメア長を延長するテロメラーゼの研究は、老化研究において重要になるだろう。
(参考文献)
「わかる実験医学シリーズ 老化研究がわかる」編集 井出利憲(羊土社)
「岩波講座 現代医学の基礎12老化と動脈硬化」編集 北徹 藤原美定(岩波書店)
不老不死への科学

